Nos últimos dez anos, a imunoterapia com células T surgiu como um dos desenvolvimentos mais promissores no tratamento do câncer. Essas terapias funcionam treinando o próprio sistema imunológico do paciente para detectar e destruir células perigosas. Apesar do sucesso, os cientistas têm lutado para explicar completamente como esses tratamentos funcionam em nível molecular. Essa falta de compreensão retardou o progresso, especialmente porque as terapias com células T funcionam bem apenas para um pequeno número de tipos de câncer e falham na maioria dos outros, por razões que permanecem pouco claras. Ganhar compreensão sobre seu modus operandi poderia ajudar a tornar essas terapias efetivas para muitos mais pacientes.
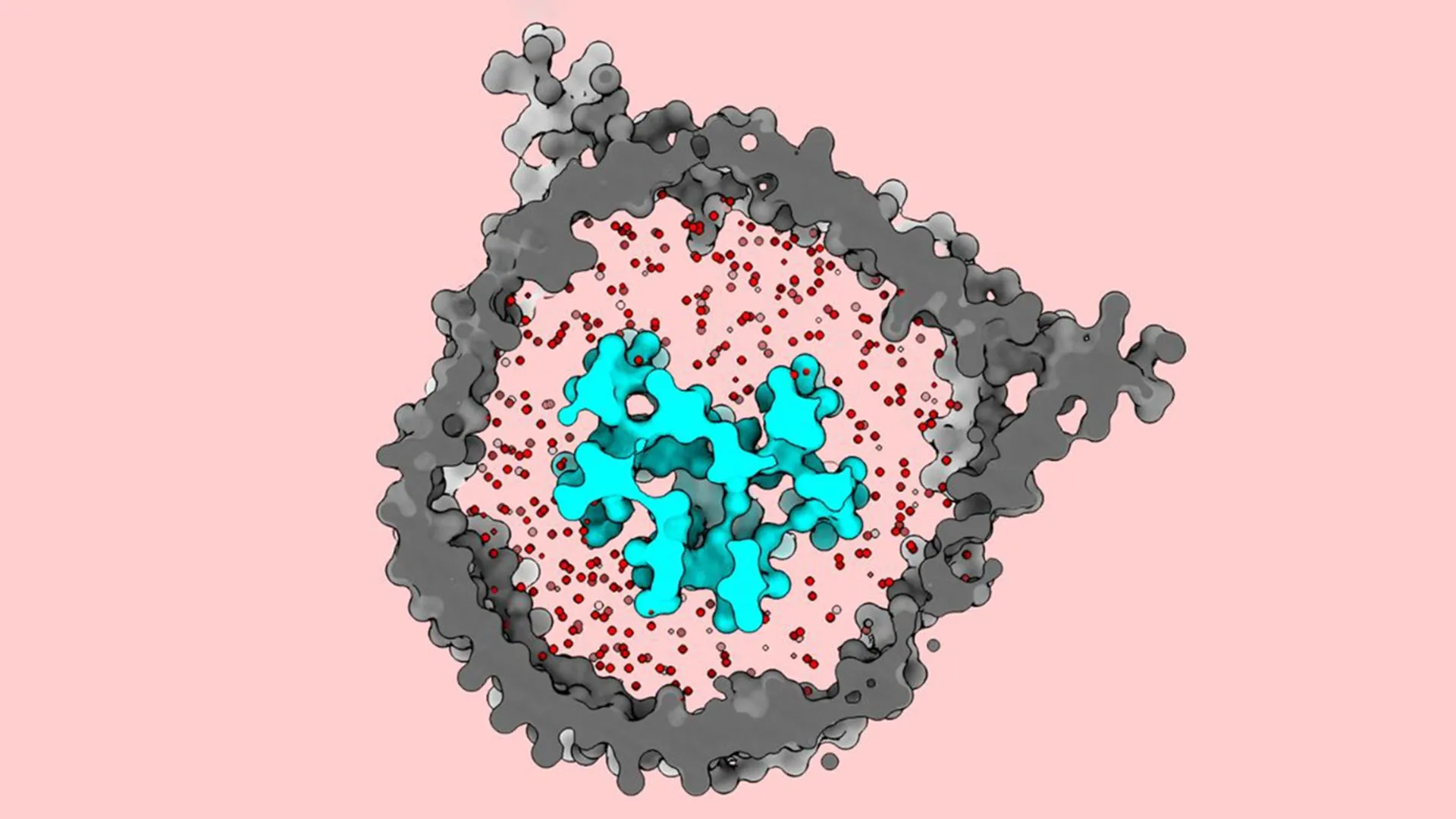
Cientistas da Universidade Rockefeller agora descobriram detalhes cruciais sobre o receptor de células T (TCR), um complexo proteico embutido na membrana celular que desempenha um papel central nas terapias com células T. Usando criomicroscopia eletrônica (cryo-EM), pesquisadores do Laboratório de Microscopia Eletrônica Molecular estudaram o receptor em um ambiente bioquímico projetado para se assemelhar ao seu contexto nativo. Eles descobriram que o TCR se comporta como um ‘jack-in-the-box’, permanecendo compacto até encontrar um antígeno ou outra partícula suspeita, momento em que se abre rapidamente. Esse comportamento contraria o que estudos anteriores de cryo-EM haviam mostrado sobre o receptor.
As descobertas, publicadas na Nature Communications, podem ajudar os pesquisadores a melhorar e expandir o uso das imunoterapias com células T.
“Esse novo entendimento fundamental de como o sistema de sinalização funciona pode ajudar a reengenheirar a próxima geração de tratamentos,” diz Ryan Notti, autor principal e instrutor de investigação clínica no laboratório de Walz, além de bolsista especial no Departamento de Medicina do Memorial Sloan Kettering Cancer Center, onde trata pacientes com sarcomas, que são cânceres que surgem em tecidos moles ou ossos.
“O receptor de células T é realmente a base de praticamente todas as imunoterapias oncológicas, então é notável que usemos o sistema, mas realmente não tenhamos ideia de como ele funciona – e é aí que a ciência básica entra,” diz Walz, um especialista mundial em imagem cryo-EM. “Este é um dos trabalhos mais importantes que já saíram do meu laboratório.”
Como as Células T Detectam Ameaças
O laboratório de Walz se concentra em produzir imagens detalhadas de complexos macromoleculares, especialmente proteínas encontradas nas membranas celulares que ajudam as células a se comunicarem com seu ambiente. O TCR é um desses complexos. Composto por várias proteínas, ele permite que as células T reconheçam antígenos apresentados por complexos de antígenos leucocitários humanos (HLA) em outras células. Esse processo de reconhecimento é o que as terapias com células T dependem para mobilizar o sistema imunológico contra o câncer.
Embora os cientistas conheçam as partes individuais do TCR há muitos anos, os primeiros passos que desencadeiam sua ativação permanecem elusivos. Notti, que atua tanto como médico quanto pesquisador, achou esse vazio especialmente preocupante porque muitos de seus pacientes com sarcoma não estavam se beneficiando das imunoterapias com células T.
“Determinar isso ajudaria a entender como a informação chega ao interior da célula, onde esses antígenos estão sendo apresentados pelos HLAs, para o interior da célula, onde a sinalização ativa a célula T,” diz ele.
Notti obteve seu doutorado em microbiologia estrutural na Rockefeller antes de se mudar para a oncologia e sugeriu a Walz que eles investigassem essa questão não respondida juntos.
Reconstruindo o Ambiente Natural do TCR
A equipe de Walz é conhecida por criar ambientes de membrana personalizados que imitam de perto os arredores naturais das proteínas de membrana. “Podemos mudar a composição bioquímica, a espessura da membrana, a tensão e curvatura, o tamanho – todos os tipos de parâmetros que sabemos que têm influência sobre a proteína embutida,” diz Walz.
Para este estudo, os pesquisadores se propuseram a observar o TCR em condições que se assemelham muito às do interior de uma célula viva. Eles colocaram o receptor em um nanodisco, uma pequena seção em forma de disco da membrana mantida em solução por uma proteína de suporte envolta em sua borda. Montar o receptor completo foi difícil, e “obter todas as oito proteínas assembladas corretamente no nanodisco foi desafiador,” diz Notti.
Estudos estruturais anteriores do TCR confiaram em detergente, que frequentemente remove a membrana ao redor. Walz observa que esta foi a primeira vez que o complexo receptor foi restaurado a um ambiente de membrana para imagem detalhada.
Visualizando o Receptor Ativar-se
Uma vez que o TCR estava embutido no nanodisco, os pesquisadores usaram cryo-EM para visualizá-lo. As imagens mostraram que o receptor permanece fechado e compacto quando inativo. Quando encontra uma molécula apresentadora de antígeno, no entanto, a estrutura se abre e se estende para fora, assemelhando-se a um movimento abrangente.
O resultado surpreendeu a equipe. “Os dados que estavam disponíveis quando começamos esta pesquisa mostravam esse complexo como estando aberto e estendido em seu estado dormente,” explica Notti. “Até então, acreditava-se que o receptor de células T não passava por nenhuma mudança conformacional ao se ligar a esses antígenos. Mas descobrimos que ele se abre, como uma espécie de jack-in-the-box.”
Os pesquisadores acreditam que dois fatores tornaram essa descoberta possível. Primeiro, recriaram cuidadosamente o ambiente da membrana in vivo do TCR usando a mistura lipídica correta. Segundo, reinseriram o receptor em uma membrana usando nanodiscos antes de realizar a imagem cryo-EM. Eles descobriram que uma membrana intacta mantém o receptor em uma posição fechada até que a ativação ocorra. Em estudos anteriores, o detergente pode ter removido essa restrição, permitindo que o receptor se abrisse prematuramente.
“Foi importante que usamos uma mistura lipídica que se assemelhasse à da membrana nativa da célula T,” diz Walz. “Se apenas tivéssemos usado um lipídio modelo, não teríamos visto esse estado dormente fechado também.”
Implicações para Terapias e Vacinas contra o Câncer
A equipe acredita que suas descobertas podem ajudar a melhorar tratamentos que dependem de receptores de células T. “Reengenheirar a próxima geração de imunoterapias é uma das maiores necessidades clínicas não atendidas,” diz Notti. “Por exemplo, terapias com células T adotivas estão sendo usadas com sucesso para tratar certos sarcomas muito raros, então pode-se imaginar usar nossas percepções para reengenheirar a sensibilidade desses receptores ajustando seu limiar de ativação.”
Walz também vê aplicativos potenciais além da terapia do câncer. “Essas informações podem ser usadas também para o design de vacinas,” acrescenta. “Pessoas na área agora podem usar nossas estruturas para ver detalhes refinados sobre as interações entre diferentes antígenos apresentados por HLA e receptores de células T. Esses diferentes modos de interação podem ter algumas implicações para como o receptor funciona – e maneiras de otimizá-lo.”